アプリ作品の情報
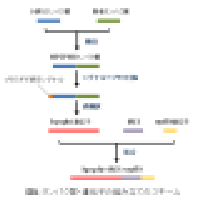
本デザインは、細胞壁固定型ホルムアルデヒド脱水素酵素の発現により、植物にホルムアルデヒド無毒化能を付与することを目指したものである。細胞壁結合型ホルムアルデヒド脱水素酵素は、Pseudomonas putidaのホルムアルデヒド脱水素酵素のC末端にHeterodera schachtiiのセルロース結合タンパク質を融合した後、N末端に小胞体移行シグナルを付加して作製した。この酵素は植物の細胞壁中に留まって不均化反応を触媒し、植物体を細胞外のホルムアルデヒドから効率的に保護すると期待される。また、本デザインに基づく組換え植物には、ホルムアルデヒド無毒化繊維の原料として活用できる可能性がある。
6
評価指数
いいね!
3
Loading...
アプリケーション
| |||||||||||||||||||||||
| 作者 | ||
|---|---|---|
| Fork元のアプリ |
 Masahiro Mochizuki
's
GenoConの非公式デザイン例
Masahiro Mochizuki
's
GenoConの非公式デザイン例
|
|
| 実行回数 | 560 | |
| ウェブサイト | ||
| ライセンス |

|
|
| Fork count | 1 | |
| 作成日 | 2012年10月6日 | |
| 最終更新日 | 2012年12月29日 | |
- このアプリ作品で入力データとして使われているデータ作品のリストです。
- チェックボックスの選択を変更すると、入力データを変更して実行することができます。